FILAMENTOS INTERMEDIOS
| ||
Los filamentos intermedios son un elemento del citoesqueleto que aportan resistencia mecánica. Se anclan a los complejos de unión.
Se distribuyen por el citoplasma y forman parte de la envuelta nuclear. Están formados por monómeros con dos dominios: cabezas globulares y zona intermedia lineal. Hay distintos tipos, destacando las queratinas.
Son componentes del citoesqueleto cuya principal misión es permitir a las células o estructuras celulares soportar tensiones mecánicas. Esta función es obvia en las células animales, pero no en las células de las plantas donde el papel de resistencia mecánica lo llevan a cabo las paredes celulares. En las células de las plantas se han detectado proteínas similares a los filamentos intermedios pero su papel es desconocido.
Se denominan intermedios porque su diámetro es de aproximadamente 8 a 15 nm, que se encuentra entre los de los filamentos de actina (7 a 8 nm) y los microtúbulos (25 nm). Se encuentran presentes en las células animales, aunque no en todas. Forman una red que contacta con el núcleo y se extiende hasta la periferia celular. Normalmente están anclados a los complejos de unión (desmosomas, hemidesmosomas, las uniones focales) que se establecen entre células vecinas y la matriz extracelular (hemidesmosomas) a través de proteínas de unión. También se han encontrado filamentos intermedios en el núcleo donde forman la lámina nuclear ☆, un entramado que da forma y aporta cohesión a la envuelta nuclear. Abundan los filamentos intermedios en las células que están sometidas a tensiones mecánicas. Por ejemplo en los axones de las células nerviosas, en las musculares y en las epiteliales.

Esquema de la disposición de los filamentos intermedios en una célula animal en cultivo.
En humanos hay 70 genes diferentes que codifican para proteínas de filamentos intermedios, que al polimerizar forman los filamentos intermedios que se observan en las células. Pero además se pueden maduración alternativa del ARNm (alternative splicing) resultando en más formas proteicas diferentes. Estos monómeros o subunidades están formados por una cabeza globular en el extremo amino, una cola globular en el extremo carboxilo y un dominio central alargado o región central con unos 310 a 350 aminoácidos. Las cabezas o zonas globulares son las regiones de la proteína encargadas de interaccionar con otros componentes celulares. En los distintos tipos de filamentos intermedios estas cabezas son variables en forma y secuencia de aminoácidos. La organización molecular es importante para que estas proteínas se asocien entre sí de manera espontánea. La región central se organiza en una hélice alfa que permite a un monómero unirse a otro para formar dímeros. Dos de estos dímeros pueden asociarse entre sí de forma antiparalela mediante enlaces eléctricos para formar tetrámeros. Los tetrámeros se asocian lateralmente para formar una estructura laminada de 8 tetrámeros, que se enrrolla sobre sí misma, y se une en línea con otras para formar el filamento intermedio de unos 8 a 10 nm. La estructura formada por la longitud de 4 tetrámeros forma la unidad fundamental de ensamblaje de unos 60 nm de longitud. Las unidades fundamentales se asocian por sus extremos para formar los filamentos intermedios a modo de cuerda. Las zonas centrales de los monómeros son muy parecidas entre los distintos tipos de filamentos intermedios, en tamaño y secuencia de animoácidos, por lo que todos tienen un diámetro y forma parecidos.
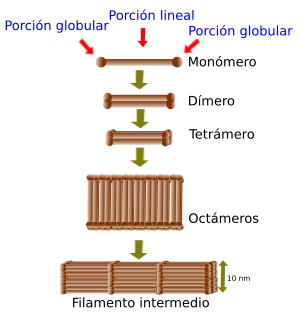
Esquema del ensamblaje de los filamentos intermedios a partir de monómeros.
Los filamentos intermedios son flexibles y resistentes, dos propiedades óptimas para soportar las tensiones mecánicas. Se ha estimado que pueden estirarse entre un 250 y un 350 % de su longitud inicial cuando se someten a fuerzas de tensión. Cuando esto ocurre disminuyen su diámetro, por lo que se estima que los monómeros pueden deslizarse unos sobre otros. Esto contrasta con los microtúbulos y los filamentos de actina, los cuales son relativamente rígidos. Además de en esta función de resistencia parece que intervienen en otros procesos celulares. Se les postula como lugar de anclaje de numerosas moléculas de señalización. Además, interaccionan directamente con orgánulos como las mitocondrias, el aparato de Golgi y los lisosomas, por lo que pueden afectar a su funcionamiento y al propio tráfico vesicular. Por ejemplo, se ha encontrado que la vimentina, un tipo de filamento intermedio, interacciona con las proteínas Rab, las cuales son necesarias para el reparto de las vesículas del tráfico vesicular.
Aunque los filamentos intermedios son más estables en el tiempo que los microtúbulos o los filamentos de actina, también pueden desorganizarse y volver a polimerizar bajo ciertas condiciones celulares como durante el desplazamiento celular, división celular o cuando se responde a cambios en la dirección de las fuerzas tensoras que soportan las células.
Los filamentos intermedios se clasifican en 6 grupos o clases. I y II son las queratinas ácidas y básicas respectivamente. Ambos tipos se combinan entre sí para dar las queratinas de las células, es decir, las queratinas son heteropolímeros. Las queratinas son abundantes en las célula epiteliales. III es una clase heterogénea donde destacan la vimentina, desmina, proteína glial fibrilar ácida y la periferina. IV es un grupo que incluye a los neurofilmentos, típicos de neuronas, a la semina, sincoilina y a la alfa-internexina. V es una clase que incluye a las láminas nucleares que forman la lámina nuclear, son los únicos filamentos intermedios que no se encuentran en el citoplasma. VI es una nueva clase añadida recientemente que incluye a proteinas de las lentes del ojo como filensina y la faquinina.
La familia de filamentos intermedios con más diversidad en sus monómeros es la de las queratinas. Así, se han encontrado monómeros diferentes en epitelios diferentes, también aparecen queratinas especiales en el pelo, las plumas y las uñas. En cada caso los filamentos de queratina son el resultado de una mezclas de distintos tipos de monómeros de queratinas. Otros filamentos intermedios también forman heteropolímeros, es decir, asociaciones entre filamentos intermedios correspondientes a clases diferentes.
Los filamentos de queratina en las células epiteliales☆ suelen estar anclados a los desmosomas y a los hemidesmosomas. La importancia de esto queda patente en una enfermedad llamada epidermolisis bullosa simple, en la cual existen mutaciones que modifican la formación de los filamentos de queratina. El resultado es una piel muy vulnerable al daño mecánico, es decir, hace falta muy poca presión para separar las células y producir descamación. Ésta es sólo una de las más de 75 enfermedades humanas asociadas a defectos en los filamentos intermedios entre las que se encuentran miopatías, esclerosis lateral amiotrófica, Parkinson, cataratas, etcétera.
| ||
PodologiaGlobal
domingo, 12 de febrero de 2017
Queratina.
Introducción.
Entendemos por queratina un grupo de proteínas fibrilares citoesqueléticas, de la familia de los
filamentos intermedios. Se trata de una proteína con capacidad de endurecer el tejido en el que se
acumula. A los tejidos cargados de queratina se les denomina queratinizados o cornificados.
La queratina en grandes cantidades puede tornar un tejido extremadamente duro: solo debemos
pensar en las garras de los grandes felinos o en los cuernos de un rinoceronte para darnos cuenta de
su fortaleza.
Encontramos queratinas en varios tejidos, pero el lugar más
característico es, sin duda, la piel y sus anexos. En el ser humano,
encontramos cantidades significativas de queratina en la epidermis,
sobre todo en estratos superiores, y en los anexos cutáneos
cornificados: las uñas y los pelos.
En este apartado analizaremos las queratinas más habituales en las
células de la piel y anexos cutáneos humanos, repasando los aspectos
más destacados de su biosíntesis
La familia de las queratinas.
Cuando hablamos de queratina solemos referirnos a un conjunto de proteínas de gran tamaño,
constituidas por la unión de filamentos de tamaño mucho menor.
Las subunidades básicas de la queratina se dividen en dos
grandes grupos: queratinas ácidas y queratinas básicas (y
neutras). Estas subunidades básicas están constituidas por una
sola proteína, mayormente de morfología espiral (abundantes
hélices alfa). Y poseen cantidades especialmente abundantes
de un aminoácido concreto: la cisteína (aunque la cantidad
final es variable en función del tipo de queratina).
Hay veinte precursores de la queratina, denominados del uno
al veinte (como K1, K2... hasta K20). De ellos, los ocho
primeros (K1 a K8) son queratinas básicas o neutras. El resto (de K9 a K20) son queratinas ácidas.
De entre las básicas y neutras, la K1 y K2 son típicas de la piel. De entre las básicas, las más
características de la piel son K9 y K10.
La unión de estos veinte precursores nos dará lugar a los distintos tipos
de queratina. Se han descrito al menos treinta tipos de queratina
diferentes en distintos tejidos animales.
En el ser humano, todos estos tipos de queratina se pueden agrupar en
dos conjuntos: las queratinas blandas, que constituyen la epidermis y el
vello fino (casi invisible) y las queratinas duras que forman parte de los
pelos gruesos y de las uñas. Las primeras son más ricas en componentes
hidrosolubles y más pobres en azufre, mientras que las segundas son más
pobres en componentes hidrosolubles y más ricas en azufre.
Fabricación de queratina.
Los monómeros de queratina se unen entre si para formar dímeros. El dímero es el primer
precursor de la gran molécula de la queratina en el que entran en juego varias proteínas (dos, como
su nombre indica). Y la unión no tiene lugar de cualquier manera, sino de una forma muy concreta:
una subunidad ácida se unirá con una subunidad básica. De esta forma, la macromolécula acabará
teniendo la misma proporción de subunidades básicas que de subunidades ácidas.
Posteriormente dos dímeros se unirán entre si para formar tetrámeros. Multitud tetrámeros se unen
entre si, unos detrás de otros, dando lugar a los protofilamentos. Al microscipio electrónico, los
protofilamentos constituyen un elemento fibrilar homogéneo.
Varios protofilamentos se unen entre si, en grupos de unos cuatro protofilamentos, formando una
protofibrilla.
A partir de estas protofibrillas bien cohesionadas se formarán las grandes moléculas de queratina
uniéndose muchas subunidades y torsionándose formando un trenzado. Para ello, se requiere de la presencia de una molécula que hará de puente entre los precursores de la queratina. Hablamos de la
filagrina. La filagrina.
La filagrina aparece de forma conjunta a la queratina en los gránulos de queratohialina que abundan
en el citoplasma de las células epiteliales de la epidermis a partrir de las capas superiores del estrato
espinoso.
Como indicamos, su función es formar puentes de unión entre las moléculas de queratina, es decir,
constituyen una suerte de cemento molecular que mantiene las moléculas unidas y asegura que su
unión, fusión y plegamiento son los correctos.
La filagrina se fabrica a partir de un precursor: la profilagrina. La profilagrina es una proteína de
gran tamaño. Sufrirá una serie de cortes específicos, obteniéndose la filagrina, que es una molécula
de tamaño relativamente pequeño. Una sola molécula de profilagrina, de hecho, contiene entre diez
y doce subunidades de filagrina repetidas, que se separarán por el proceso de corte.
Es decir, la filagrina se forma a partir de un precursos de gran tamaño, llamado profilagrina, que
sufre una serie de cortes específicos (modificaciones postraduccionales).
En los estratos superiores de la epidermis buena parte de la filagrina degenera, se hidroliza y pasa a
formar parte de las sustancias orgánicas que se van depositando sobre la piel y que constituyen,
entre otras cosas, el factor natural de hidratación.
Queratina y azufre.
Desde hace tiempo se conoce la importancia para las queratinas de su contenido en azufre. Ya
hemos indicado que se relaciona con su dureza. Analicemos las causas.
El azufre deriva de un componente habitual en las queratinas: un aminoácido denominado cisteína y
que posee azufre en su molécula. Las cisteínas de distintas cadenas de queratina pueden unirse entre
si, así como con las queratinas de otras proteínas, como las filagrinas, mediante puentes disulfuro
(formando un puente de unión y hablandose de cistina al referirnos a dos aminoácidos de cistina de
distintas cadenas unidas por un puente disulfuro).
Por esto, cuanto más rica en azufre sea una queratina, mayor cantidad de puentes disulfuro podrá
establecer con moléculas vecinas, endureciendo o haciendo más correosa la estructura.
Esta es la razón, así mismo, de que compuestos encargados de reblandecer la queratina, como
algunos exfoliantes o los depilatorios químicos, basan su actuación en la degradación y eliminación
de puentes disulfuro. Al eliminar estos puentes, las moléculas de queratina se separan entre si,
pierden cohesión y la proteína ve reducida considerablemente su dureza. Además, los puentes
peptídicos que unen los aminoácidos entre si quedan más expuestos, pudiendo ser degradados
mediante otros compuestos químicos o sencillamente elevando el pH a niveles que los
desestabilicen.
Los depilatorios químicos usan, por ejemplo, ácido tioglicólico a pH 11 aproximadamente y en
menos de cinco minutos son capaces de degradar la queratina hasta tal punto, que los pelos pueden
ser eliminados con una paleta de plástico.
Introducción.
Entendemos por queratina un grupo de proteínas fibrilares citoesqueléticas, de la familia de los
filamentos intermedios. Se trata de una proteína con capacidad de endurecer el tejido en el que se
acumula. A los tejidos cargados de queratina se les denomina queratinizados o cornificados.
La queratina en grandes cantidades puede tornar un tejido extremadamente duro: solo debemos
pensar en las garras de los grandes felinos o en los cuernos de un rinoceronte para darnos cuenta de
su fortaleza.
Encontramos queratinas en varios tejidos, pero el lugar más
característico es, sin duda, la piel y sus anexos. En el ser humano,
encontramos cantidades significativas de queratina en la epidermis,
sobre todo en estratos superiores, y en los anexos cutáneos
cornificados: las uñas y los pelos.
En este apartado analizaremos las queratinas más habituales en las
células de la piel y anexos cutáneos humanos, repasando los aspectos
más destacados de su biosíntesis
La familia de las queratinas.
Cuando hablamos de queratina solemos referirnos a un conjunto de proteínas de gran tamaño,
constituidas por la unión de filamentos de tamaño mucho menor.
Las subunidades básicas de la queratina se dividen en dos
grandes grupos: queratinas ácidas y queratinas básicas (y
neutras). Estas subunidades básicas están constituidas por una
sola proteína, mayormente de morfología espiral (abundantes
hélices alfa). Y poseen cantidades especialmente abundantes
de un aminoácido concreto: la cisteína (aunque la cantidad
final es variable en función del tipo de queratina).
Hay veinte precursores de la queratina, denominados del uno
al veinte (como K1, K2... hasta K20). De ellos, los ocho
primeros (K1 a K8) son queratinas básicas o neutras. El resto (de K9 a K20) son queratinas ácidas.
De entre las básicas y neutras, la K1 y K2 son típicas de la piel. De entre las básicas, las más
características de la piel son K9 y K10.
La unión de estos veinte precursores nos dará lugar a los distintos tipos
de queratina. Se han descrito al menos treinta tipos de queratina
diferentes en distintos tejidos animales.
En el ser humano, todos estos tipos de queratina se pueden agrupar en
dos conjuntos: las queratinas blandas, que constituyen la epidermis y el
vello fino (casi invisible) y las queratinas duras que forman parte de los
pelos gruesos y de las uñas. Las primeras son más ricas en componentes
hidrosolubles y más pobres en azufre, mientras que las segundas son más
pobres en componentes hidrosolubles y más ricas en azufre.
Fabricación de queratina.
Los monómeros de queratina se unen entre si para formar dímeros. El dímero es el primer
precursor de la gran molécula de la queratina en el que entran en juego varias proteínas (dos, como
su nombre indica). Y la unión no tiene lugar de cualquier manera, sino de una forma muy concreta:
una subunidad ácida se unirá con una subunidad básica. De esta forma, la macromolécula acabará
teniendo la misma proporción de subunidades básicas que de subunidades ácidas.
Posteriormente dos dímeros se unirán entre si para formar tetrámeros. Multitud tetrámeros se unen
entre si, unos detrás de otros, dando lugar a los protofilamentos. Al microscipio electrónico, los
protofilamentos constituyen un elemento fibrilar homogéneo.
Varios protofilamentos se unen entre si, en grupos de unos cuatro protofilamentos, formando una
protofibrilla.
A partir de estas protofibrillas bien cohesionadas se formarán las grandes moléculas de queratina
uniéndose muchas subunidades y torsionándose formando un trenzado. Para ello, se requiere de la presencia de una molécula que hará de puente entre los precursores de la queratina. Hablamos de la
filagrina. La filagrina.
La filagrina aparece de forma conjunta a la queratina en los gránulos de queratohialina que abundan
en el citoplasma de las células epiteliales de la epidermis a partrir de las capas superiores del estrato
espinoso.
Como indicamos, su función es formar puentes de unión entre las moléculas de queratina, es decir,
constituyen una suerte de cemento molecular que mantiene las moléculas unidas y asegura que su
unión, fusión y plegamiento son los correctos.
La filagrina se fabrica a partir de un precursor: la profilagrina. La profilagrina es una proteína de
gran tamaño. Sufrirá una serie de cortes específicos, obteniéndose la filagrina, que es una molécula
de tamaño relativamente pequeño. Una sola molécula de profilagrina, de hecho, contiene entre diez
y doce subunidades de filagrina repetidas, que se separarán por el proceso de corte.
Es decir, la filagrina se forma a partir de un precursos de gran tamaño, llamado profilagrina, que
sufre una serie de cortes específicos (modificaciones postraduccionales).
En los estratos superiores de la epidermis buena parte de la filagrina degenera, se hidroliza y pasa a
formar parte de las sustancias orgánicas que se van depositando sobre la piel y que constituyen,
entre otras cosas, el factor natural de hidratación.
Queratina y azufre.
Desde hace tiempo se conoce la importancia para las queratinas de su contenido en azufre. Ya
hemos indicado que se relaciona con su dureza. Analicemos las causas.
El azufre deriva de un componente habitual en las queratinas: un aminoácido denominado cisteína y
que posee azufre en su molécula. Las cisteínas de distintas cadenas de queratina pueden unirse entre
si, así como con las queratinas de otras proteínas, como las filagrinas, mediante puentes disulfuro
(formando un puente de unión y hablandose de cistina al referirnos a dos aminoácidos de cistina de
distintas cadenas unidas por un puente disulfuro).
Por esto, cuanto más rica en azufre sea una queratina, mayor cantidad de puentes disulfuro podrá
establecer con moléculas vecinas, endureciendo o haciendo más correosa la estructura.
Esta es la razón, así mismo, de que compuestos encargados de reblandecer la queratina, como
algunos exfoliantes o los depilatorios químicos, basan su actuación en la degradación y eliminación
de puentes disulfuro. Al eliminar estos puentes, las moléculas de queratina se separan entre si,
pierden cohesión y la proteína ve reducida considerablemente su dureza. Además, los puentes
peptídicos que unen los aminoácidos entre si quedan más expuestos, pudiendo ser degradados
mediante otros compuestos químicos o sencillamente elevando el pH a niveles que los
desestabilicen.
Los depilatorios químicos usan, por ejemplo, ácido tioglicólico a pH 11 aproximadamente y en
menos de cinco minutos son capaces de degradar la queratina hasta tal punto, que los pelos pueden
ser eliminados con una paleta de plástico.
viernes, 10 de febrero de 2017
MARTES, 8 DE ABRIL DE 2014
TÉCNICA H DE FROST
La técnica en "H" de Frost es la que más se emplea, se puede utilizar en todas las falanges, pero lo más común en el 1er dedo.
Pasos a seguir:
1.- Se realiza el primer pinchazo en la parte interna del hallux (canal peroneal), y cuando nos encontramos a nivel plantar depositamos la cantidad apropiada de anestesico
2.- Cuando ya hemos depositado en el anestésico y estamos retirando la aguja, antes de retirarla por completo dirigimos la aguja transversalmente por debajo del tendón de extensor del 1er dedo (para ello realizaremos una dorsiflexión del hallux), y depositamos mas anestésico, por último retiramos la aguja y esperamos a que el anestésico empiece a hacer efecto
3.- Por último realizamos un ultimo pinchazo en la parte lateral del hallux (canal tibial), e inyectamos los últimos mililitros de anestésico para insensibilizar esta zona. Este último pinchazo no duele porque al realizar el abordaje transversal por debajo del extensor del 1er dedo ya hemos depositado ahí anestésico.
Pasos a seguir:
1.- Se realiza el primer pinchazo en la parte interna del hallux (canal peroneal), y cuando nos encontramos a nivel plantar depositamos la cantidad apropiada de anestesico
2.- Cuando ya hemos depositado en el anestésico y estamos retirando la aguja, antes de retirarla por completo dirigimos la aguja transversalmente por debajo del tendón de extensor del 1er dedo (para ello realizaremos una dorsiflexión del hallux), y depositamos mas anestésico, por último retiramos la aguja y esperamos a que el anestésico empiece a hacer efecto
3.- Por último realizamos un ultimo pinchazo en la parte lateral del hallux (canal tibial), e inyectamos los últimos mililitros de anestésico para insensibilizar esta zona. Este último pinchazo no duele porque al realizar el abordaje transversal por debajo del extensor del 1er dedo ya hemos depositado ahí anestésico.
La anestesia local es sencilla pero desde luego encierra riesgos.
Veal el siguiente vídeo
viernes, 4 de marzo de 2011
El trabajo mata.
El dulce festín del panal de miel ha acompañado a los humanos hasta nuestros días, así lo atestiguan diversas pinturas rupestres encontradas, entre las mas importantes de España están las de La Cueva de la Araña (Bicorp ,Valencia),que con una antigüedad de 7000 años A.C. narran escenas de la recolección de miel de los panales en colmenas silvestres. La recolección de miel de los primeros humanos era una actividad, similar a la caza consistía en localizar la colmena silvestre, eliminar o reducir a las abejas y coger los panales de miel. Hoy en dia los cazadores de miel del Himalaya recogen enormes panales de miel y cría de la raza de abejas silvestres Apis laboriosa, o también las tribus ancestrales del continente africano entre la que están los pigmeos cuyas costumbres y modos de vida han permanecido inalterados a lo largo de miles de años siguen recolectando la miel de forma parecida a como la recolectaban nuestros antepasados europeos. Pronto comprobó el hombre que el humo las paralizaba, aun hoy no se sabe con certeza porque, quizás su instinto de supervivencia las anima a atiborrarse de miel por si tienen que huir a buscar otro refugio, esto las impide defenderse con precisión y soltura, el caso es que desde entonces el humo es el principal aliado del hombre para conseguir apoderarse de sus reservas de miel. En cada colmena existen cerca de 60.000 obreras, 1 reina y centenas de zánganos. Pero hay un asunto respecto de la abejas que me resulta muy interesante y cautivador, sus alas. Las alas Las alas son extensiones bien finas del integumento. Se forman mediante la unión de dos capas de exoesqueleto. Las mismas son fortalecidas por estructuras tubulares conocidas como venas. A través de ellas fluye hemolinfa. La abeja tiene dos pares de alas, una anterior y otra posterior, de menor tamaño. Ambas se unen en el vuelo por los ganchos de las alas o ámulos. Estos hacen factible el que ambas alas batan al unísono. Cuando no están en vuelo, las alas son dobladas sobre el tórax y el abdomen gracias a una combinación de estructuras quitinosas y membranas que interactúan con músculos. El hecho que los insectos hayan tenido un éxito tan marcado en evolucionar y colonizar la tierra depende en gran medida de, primero haber desarrollado alas y segundo desarrollar esta habilidad de doblar las alas sobre el cuerpo. Siendo membranas finas, las alas son relativamente frágiles y de hecho sufren daño significativo como resultado de la actividad de vuelo, resultado de la fricción con el aire. Esta es una de las razones por las que las obreras tienen un largo de vida tan corto. No es porque fisiológicamente se agoten o envejezcan, sino que sus alas se van acortando según se gastan sus puntas y eventualmente no tienen suficiente superficie de área para elevar su peso, lo que imposibilita que regresen a la colonia. Esto se percibe muy claramente si comparamos el ala de una abeja recién nacida con la de una pecoreadora adulta. Así que, dicho de otro modo, después de una vida entregada al trabajo en exceso y de producir mas riqueza de lo necesario, riqueza que es aprovechada por otros; la abeja finalmente recibe su premio, morir solo fuera de la colmena, no por el trabajo agotador sino porque la naturaleza no le doto de la capacidad de regenerar sus alas y cae imposibilitada para el vuelo, condenada a la muerte, fuera de la colmena para evitar la molestia e mover su cuerpo. Si algunos de nosotros encontramos algún parecido de estos hechos con nuestra propia vida, es mera coincidencia. Muchos nacemos solo con el ideal de trabajar y trabajar SOLO con el objeto de acumular cosas que al final solo servirán para que alguien mas lo posea o se beneficie,un trabajo carente de sentido y sin beneficio duradero, si acaso aquéllos trabajos que salvan vidas, o que marcan la historia, pero al final nada nos llevamos, si, cuando Marilyn Monroe murió ella en vida jamas imaginó que todas sus posesiones, a la larga, serian subastadas y llegarían a ser posesión de personas que ni siquiera conocía, aun hasta sus zapatillas que se subastaron en miles de dolares, como sea, el trabajo mata.
lunes, 21 de febrero de 2011
El estrato corneo y la implicación en hiperkeratosis.
La envoltura proteínica córnea es una compleja estructura que sustituye a la membrana plasmática fosfolipídica que poseen los queratinocitos. Conocida en la bibliografía en inglés como cornified envelope, sabemos que su presencia es muy importante en los corneocitos, ya que forma parte de los componentes que permiten desarrollar la función barrera del estrato córneo. La superficie corporal está recubierta por millones de corneocitos que aíslan eficazmente las células epidérmicas viables del medio externo que se caracteriza por su elevada sequedad, su importante presión de oxígeno y su potencial capacidad de desarrollar una agresión química y microbiológica. Normalmente, los corneocitos superpuestos alcanzan 20 estratos celulares, aunque en las zonas cutáneas plantares y palmares pueden contabilizarse hasta 1. 000. Diversas patologías cutáneas (que cursan como una hiperqueratosis) también incrementan de forma muy acusada esta superposición de corneocitos. La función barrera que es propia del estrato córneo se considera que se desarrolla en los estratos más profundos de los corneocitos. Todas las células córneas poseen una forma muy aplanada, apropiada para su óptima superposición. En los corneocitos abunda una trama de filamentos de queratinas muy densamente agregados por la presencia de otra proteína, denominada filagrina. Tanto las queratinas como la filagrina forman el modelo queratínico (keratina pattern) que sustituye totalmente el citoplasma, el núcleo los diversos orgánulos propios de los queratinocitos de la epidermis. Este contenido exclusivamente proteínico de las células córneas se halla rodeado por una envoltura proteínica densa, el antes citado cornified envelope, que sustituye a la membrana plasmática fosfolipídica de los queratinocitos. La diferenciación epidérmica finaliza en una zona de transición, en la que unos pocos queratinocitos granulosos se suicidan mediante la actividad de las enzimas hidrolíticas contenidas en los lisomas: proteasas, nucleasas, fosfolipasas, etc. Es muy evidente que esta peculiar membrana está formada por numerosas proteínas entrelazadas mediante enlaces cruzados covalentes, cuyo espesor se sitúa en unos 10nm, aunque en su cara externa la envoltura posee una importante cobertura lipídica, de unos 5 nm de grosor , distribuida como una empalizada fijada también mediante enlaces covalentes 1. Las células córneas superpuestas conservan unos puntos de fijación denominados corneodesmosomas, cuya composición glucoproteínica sólo coincide en parte con la de los desmosomas que conectan entre sí a los queratinocitos. Los espacios extracelulares que se hallan entre corneocitos contiguos, y que no están ocupados por los corneodesmososmas, contienen una sustancia cementante exclusivamente lipídica, de grosor muy variable , que se caracteriza por su agregación hidrófoba flexible y por la ausencia de enlaces covalentes entre sus diversas moléculas . Estos lípidos (moderadamente polares) se distribuyen formando estructuras lamelares superpuestas que conectan fácilmente con la empalizada lipídica situada en la zona externa del cornified envelope.
Este breve resumen nos permite aceptar la vital función barrera que desempeñan los corneocitos situados en los niveles más profundos del estrato córneo. Todos los componentes citados son decisivos en la defensa superficial de nuestro tejido cutáneo. Esta capacidad aislante y flexible del estrato córneo no sólo está implicada en nuestra salud, sino que también es muy importante para conservar una imagen estética óptima de nuestro tejido cutáneo. Vías metabólicas de la diferenciación epidérmica
En la epidermis hay queratinocitos en tres niveles o estratos celulares bien diferenciados:
* El estrato basal, en parte proliferante, con células de forma casi cúbica, situado junto a la membrana basal y por tanto expuesto a un importante aporte nutricio desde los capilares sanguíneos de las papilas dérmicas subyacentes. A este nivel los queratinocitos sólo sintetizan filamentos intermedios de queratinas, tipos K 5 y K 14, incapaces de agregarse para formar filamentos gruesos, ya que éstos podrían dificultar los procesos de mitosis.
Este breve resumen nos permite aceptar la vital función barrera que desempeñan los corneocitos situados en los niveles más profundos del estrato córneo. Todos los componentes citados son decisivos en la defensa superficial de nuestro tejido cutáneo. Esta capacidad aislante y flexible del estrato córneo no sólo está implicada en nuestra salud, sino que también es muy importante para conservar una imagen estética óptima de nuestro tejido cutáneo. Vías metabólicas de la diferenciación epidérmica
En la epidermis hay queratinocitos en tres niveles o estratos celulares bien diferenciados:
* El estrato basal, en parte proliferante, con células de forma casi cúbica, situado junto a la membrana basal y por tanto expuesto a un importante aporte nutricio desde los capilares sanguíneos de las papilas dérmicas subyacentes. A este nivel los queratinocitos sólo sintetizan filamentos intermedios de queratinas, tipos K 5 y K 14, incapaces de agregarse para formar filamentos gruesos, ya que éstos podrían dificultar los procesos de mitosis.
* El estrato espinoso, en posición suprabasal, formado por células globulosas desplazadas tras la proliferación del estrato basal. Sólo ocasionalmente pueden proliferar, lo que explica que se observen desmosomas muy densos, en los que se visualizan filamentos gruesos de queratinas, con aspecto de espinas.
Estas células inician el proceso de diferenciación, y sintetizan los primeros gránulos de recubrimiento de la membrana (conocidos como corpúsculos de Odland). En el interior de estos orgánulos se acumulan enzimas y glucolípidos precursores de los que requiere el estrato córneo.
Estas células inician el proceso de diferenciación, y sintetizan los primeros gránulos de recubrimiento de la membrana (conocidos como corpúsculos de Odland). En el interior de estos orgánulos se acumulan enzimas y glucolípidos precursores de los que requiere el estrato córneo.
* El estrato granuloso, formado por células más aplanadas, cuyo relativamente escaso
contenido acuoso requiere la presencia de osmolitos (para retener unos valores hídricos
que permitan una importante actividad de síntesis). El proceso de diferenciación se acelera, ya que se incrementa de forma espectacular el número de corpúsculos de Odland, se sintetizan queratinas de tipo K 1 y K 10 (capaces de agregarse en presencia de filagrina ) y aparecen numerosas granulaciones de aspecto amorfo , en las que se acumulan diferentes proteínas.
contenido acuoso requiere la presencia de osmolitos (para retener unos valores hídricos
que permitan una importante actividad de síntesis). El proceso de diferenciación se acelera, ya que se incrementa de forma espectacular el número de corpúsculos de Odland, se sintetizan queratinas de tipo K 1 y K 10 (capaces de agregarse en presencia de filagrina ) y aparecen numerosas granulaciones de aspecto amorfo , en las que se acumulan diferentes proteínas.
La diferenciación epidérmica finaliza en una zona de transición, en la que unos pocos
queratinocitos granulosos se suicidan mediante la actividad de las enzimas hidrolíticas
contenidas en los lisomas: proteasas, nucleasas, fosfolipasas, etc. Estas enzimas destruyen las proteínas que no requieren los corneocitos, así como el núcleo celular y los diversos orgánulos que tienen membranas fosfolipídicas (incluida la propia membrana plasmática del queratinocito granuloso).
queratinocitos granulosos se suicidan mediante la actividad de las enzimas hidrolíticas
contenidas en los lisomas: proteasas, nucleasas, fosfolipasas, etc. Estas enzimas destruyen las proteínas que no requieren los corneocitos, así como el núcleo celular y los diversos orgánulos que tienen membranas fosfolipídicas (incluida la propia membrana plasmática del queratinocito granuloso).
Formación del estrato córneo
Las células córneas son discos de contorno casi poligonal, con un diámetro de unas 30 micras y un grosor de unas 0, 7 micras. Su envoltura densa proteínica y lipídica, de unos 15 nm de grosor, actúa como una membrana y se halla en contacto con un número variable de estructuras lamelares lipídicas (entre 4 y 20 estructuras superpuestas). Todos estos materiales tienen una marcada hidrofobicidad y han sido sintetizados por los queratinocitos durante su proceso de diferenciación. La función barrera del estrato córneo profundo depende de esta eficacia sintética, la que a su vez es muy dependiente de la cinética epidérmica y de la actividad metabólica de los queratinocitos. Salvo situaciones patológicas, una epidermis juvenil se renueva más rápidamente y sintetiza todos estos componentes córneos de forma más eficiente que una epidermis senil. La renovación epidérmica depende de la descamación del estrato córneo más superficial y es imperceptible, pero diversas alteraciones pueden dificultar el desprendimiento de las células, lo que causa que se liberen en la superficie cutánea masas de corneocitos fácilmente visibles. Durante la zona de transición se detectan las
siguientes alteraciones:
siguientes alteraciones:
* Cambios en la composición de algunas glucoproteínas desmosómicas, lo que convierte a estas uniones en corneodesmosomas más sensibles a la actividad hidrolítica enzimática que requiere el desprendimiento de los corneocitos superficiales.
* Acumulación de los numerosos corpúsculos de Odland en la cara interna de la membrana plasmática superior: esto permite la fusión de sus membranas y el vaciado de su contenido glucolipídico al espacio extracelular; simultáneamente se eliminan por vía enzimática los residuos de glucosa.
* Acumulación de los numerosos corpúsculos de Odland en la cara interna de la membrana plasmática superior: esto permite la fusión de sus membranas y el vaciado de su contenido glucolipídico al espacio extracelular; simultáneamente se eliminan por vía enzimática los residuos de glucosa.
* Degradación de todos los orgánulos celulares y de la propia membrana plasmática , debido a la acción de lipasas y de proteasas.
* Los gránulos de queratohialina liberan a la proteína filagrina , la que agrega a los gruesos filamentos de queratina formando una trama proteínica densa y muy hidrófoba en el interior de los corneocitos.
* Simultáneamente se inicia una compleja estructura, en la que se utilizan las restantes
proteínas de los citados gránulos de queratohialina 2. Su ensamblaje está ligado de
forma decisiva a la activación de diversas transglutaminasas. Transglutaminasas epidérmicas Las transglutaminasas (TGase) son una familia de enzimas calciodependientes que catalizan la formación de enlaces covalentes denominados puentes isopeptídicos. Estos son enlaces N- gamma - glutamil - lisina, muy estables y
resistentes, que se producen mediante la reacción de un residuo glutámico de una
proteína con un grupo amino de una lisina. Su actividad es vital para que se produzcan
algunos de los más decisivos cambios que requiere la transformación de las células vivas granulosas en células muertas córneas. Las TGase 1 y Tgase 3 son responsables de que se forme la envoltura densa proteínica que rodea a los corneocitos. Por su parte,la TGase 5 desarrolla una actividad más centrada en el proceso de diferenciación de los queratinocitos epidérmicos. TGase 1 Inicia su expresión en las células espinosas , y se fija en la membrana plasmática de los queratinocitos gracias a la presencia de determinados residuos « acilo » ( en especial miristato y palmitato ) que se hallan situados en la proximidad del grupo amino terminal de esta enzima 3 . La incorporación de una de estas cadenas grasas se produce en un dominio aceptor (cluster) formado por cinco residuos de cisteína 4. Además, con frecuencia, el grupo amino terminal de la TGase 1 se une a una molécula de la involucrina (proteína que forma parte de los gránulos de queratohialina), con lo que esta proteína también se puede hallar en contacto directo con la membrana plasmática de la célula granulosa.
Las moléculas de TGase 1 ancladas en la membrana presentan una proteólisis que las
fracciona a medida que se incrementa la diferenciación de estas células y se aproximan
a la zona de transición 5. Simultáneamente, el fragmento anclado de menor peso molecular (unos 10 KDa) acelera la diferenciación celular. Esta enzima también sufre una fosforilación sobre una serina próxima al cluster de cisteínas 6, lo que sólo se detecta cuando ha finalizado la proliferación de los queratinocitos, y se admite que este proceso favorece su inclusión en la membrana plasmática. TGase 1 requiere calcio como cofactor, que se incrementa en el interior de los queratinocitos
que se sitúan en un nivel suprabasal. Experimentalmente se ha comprobado 7 que
los ésteres del forbol, así como al ácido retinoico, incrementan el calcio intracelular, la
expresión de TGase 1, su actividad y el nivel de sustratos sobre los que puede actuar la enzima. Algunas moléculas situadas en las proximidades de la membrana plasmática regulan el comportamiento de TGase 1. La involucrina, uno de los sustratos de la enzima, puede formar un enlace cruzado, sobre todo con la glutamina 496 8. Esta proteína, en presencia de una omega - hidroxiceramida, es catalizada por la enzima para formar un enlace esterlipídico entre algunas glutaminas y el hidroxilo de la citada ceramida 9. Esta actividad es importante para que se forme el cornified envelope.
TGase 3 Sólo se ha localizado en el citoplasma de las células epidérmicas más superficiales. Tiene cuatro dominios plegados y un complejo núcleo catalítico formado por 15 cadenas peptídicas lineares que se intercalan con 15 péptidos alfahelicoidales. En realidad, la actividad enzimática reside en una tríada formada por cisteína, histidina y ácido aspártico. Pero requiere la presencia de tres iones de calcio para modificar su estructura y conformar un canal abierto, de forma cónica, que alcanza a la tríada catalítica 10. TGase 3 no sólo cataliza la formación de enlaces isopeptídicos entre proteínas que son sus sustratos naturales, sino que también interviene en enfermedades
cutáneas autoantigénicas, como la dermatitis heptiforme Además, en presencia de nucleótidos de guanina (GTP), el canal cónico permanece cerrado y la enzima inactiva , aunque la hidrólisis de GTP en GDP causa la recuperación de su actividad.
TGase 3 no sólo cataliza la formación de enlaces isopeptídicos entre proteínas que son sus sustratos naturales, sino que también interviene en enfermedades cutáneas autoantigénicas, como la dermatitis heptiforme.
proteínas de los citados gránulos de queratohialina 2. Su ensamblaje está ligado de
forma decisiva a la activación de diversas transglutaminasas. Transglutaminasas epidérmicas Las transglutaminasas (TGase) son una familia de enzimas calciodependientes que catalizan la formación de enlaces covalentes denominados puentes isopeptídicos. Estos son enlaces N- gamma - glutamil - lisina, muy estables y
resistentes, que se producen mediante la reacción de un residuo glutámico de una
proteína con un grupo amino de una lisina. Su actividad es vital para que se produzcan
algunos de los más decisivos cambios que requiere la transformación de las células vivas granulosas en células muertas córneas. Las TGase 1 y Tgase 3 son responsables de que se forme la envoltura densa proteínica que rodea a los corneocitos. Por su parte,
Las moléculas de TGase 1 ancladas en la membrana presentan una proteólisis que las
fracciona a medida que se incrementa la diferenciación de estas células y se aproximan
a la zona de transición 5. Simultáneamente, el fragmento anclado de menor peso molecular (unos 10 KDa) acelera la diferenciación celular. Esta enzima también sufre una fosforilación sobre una serina próxima al cluster de cisteínas 6, lo que sólo se detecta cuando ha finalizado la proliferación de los queratinocitos, y se admite que este proceso favorece su inclusión en la membrana plasmática. TGase 1 requiere calcio como cofactor, que se incrementa en el interior de los queratinocitos
que se sitúan en un nivel suprabasal. Experimentalmente se ha comprobado 7 que
los ésteres del forbol, así como al ácido retinoico, incrementan el calcio intracelular, la
expresión de TGase 1, su actividad y el nivel de sustratos sobre los que puede actuar la enzima. Algunas moléculas situadas en las proximidades de la membrana plasmática regulan el comportamiento de TGase 1. La involucrina, uno de los sustratos de la enzima, puede formar un enlace cruzado, sobre todo con la glutamina 496 8. Esta proteína, en presencia de una omega - hidroxiceramida, es catalizada por la enzima para formar un enlace esterlipídico entre algunas glutaminas y el hidroxilo de la citada ceramida 9. Esta actividad es importante para que se forme el cornified envelope.
TGase 3 Sólo se ha localizado en el citoplasma de las células epidérmicas más superficiales. Tiene cuatro dominios plegados y un complejo núcleo catalítico formado por 15 cadenas peptídicas lineares que se intercalan con 15 péptidos alfahelicoidales. En realidad, la actividad enzimática reside en una tríada formada por cisteína, histidina y ácido aspártico. Pero requiere la presencia de tres iones de calcio para modificar su estructura y conformar un canal abierto, de forma cónica, que alcanza a la tríada catalítica 10. TGase 3 no sólo cataliza la formación de enlaces isopeptídicos entre proteínas que son sus sustratos naturales, sino que también interviene en enfermedades
cutáneas autoantigénicas, como la dermatitis heptiforme Además, en presencia de nucleótidos de guanina (GTP), el canal cónico permanece cerrado y la enzima inactiva , aunque la hidrólisis de GTP en GDP causa la recuperación de su actividad.
TGase 3 no sólo cataliza la formación de enlaces isopeptídicos entre proteínas que son sus sustratos naturales, sino que también interviene en enfermedades cutáneas autoantigénicas, como la dermatitis heptiforme.
TGase 5 tampoco se halla fijada a las membranas plasmáticas, pero su presencia es evidente en la matriz nuclear y en el cito esqueleto de los queratinocitos espinosos y granulosos11. Es evidente que posee una actividad reguladora del proceso de diferenciación epidérmica, muy ligada al nivel de calcio intracelular. La mayoría de las proteínas presentes en los gránulos de queratohialina son sustratos con los que cataliza la formación de puentes isopeptídicos. Curiosamente, la loricrina es una proteína en la que estos enlaces no sólo permiten la formación de multímeros, sino que dan lugar a la formación de enlaces cruzados internos entre los residuos de los aminoácidos glutamina y lisina 12. Se está investigando la regulación catalítica que pueden aportar los nucleótidos GTP y ATP. Pero es evidente que niveles excesivos de TGase 5 influyen en diversas enfermedades epidérmicas; por ejemplo, contribuyen a que se exprese un fenotipo hiperqueratótico en la ictiosis.
Bibliografía
1. Nemes Z, Marekov LN, Fesus L, Steinert PM. Funcion de la trnsglutaminaza 1, 1996:
jueves, 17 de febrero de 2011
Frases de Coram Tannio
“ Quienes buscan muchos placeres en la vida no han entendido que la vida misma es un placer.” “ La Vida es una larga sucesión de decisiones y para muchos sucede que es largo poder decidirse. ” “ Este mundo se ha forjado por quienes se han atrevido a soñar, pero se ha engrandecido por los que han aprendido a vivir sin despertar. ” “ Hay muchos más insectos sobre el planeta que seres humanos, pero hay una razón para eso: la naturaleza puede ser todo, menos tonta. ” |
En paz
¿Cuán poderoso es un hombre? No importa, ante lo inconmensurable del tiempo y del olvido, ante el juicio de las cresas, de su propia ruina, nadie lo recordará. Sólo debo esforzarme para que mi propio aliento vuelva hacia aquel que lo dio, que mi propia memoria vaya a aquel que no es capaz de olvidar, donde nada se corrompe, donde el ladrón no entrará por fuerza ni en medio del sueño. Dormiré tranquilo, cuando sea capaz de entender por qué se me ha dado este cielo, y pueda decir, ¡he hecho lo que debía de haber hecho! ¡No me olvides! Estamos en paz, estamos en paz, sé que la eternidad existe, tan profunda y real como la muerte, tan imperecedero como el amor...Dios, estamos en paz.
Suscribirse a:
Entradas (Atom)

