FILAMENTOS INTERMEDIOS
| ||
Los filamentos intermedios son un elemento del citoesqueleto que aportan resistencia mecánica. Se anclan a los complejos de unión.
Se distribuyen por el citoplasma y forman parte de la envuelta nuclear. Están formados por monómeros con dos dominios: cabezas globulares y zona intermedia lineal. Hay distintos tipos, destacando las queratinas.
Son componentes del citoesqueleto cuya principal misión es permitir a las células o estructuras celulares soportar tensiones mecánicas. Esta función es obvia en las células animales, pero no en las células de las plantas donde el papel de resistencia mecánica lo llevan a cabo las paredes celulares. En las células de las plantas se han detectado proteínas similares a los filamentos intermedios pero su papel es desconocido.
Se denominan intermedios porque su diámetro es de aproximadamente 8 a 15 nm, que se encuentra entre los de los filamentos de actina (7 a 8 nm) y los microtúbulos (25 nm). Se encuentran presentes en las células animales, aunque no en todas. Forman una red que contacta con el núcleo y se extiende hasta la periferia celular. Normalmente están anclados a los complejos de unión (desmosomas, hemidesmosomas, las uniones focales) que se establecen entre células vecinas y la matriz extracelular (hemidesmosomas) a través de proteínas de unión. También se han encontrado filamentos intermedios en el núcleo donde forman la lámina nuclear ☆, un entramado que da forma y aporta cohesión a la envuelta nuclear. Abundan los filamentos intermedios en las células que están sometidas a tensiones mecánicas. Por ejemplo en los axones de las células nerviosas, en las musculares y en las epiteliales.

Esquema de la disposición de los filamentos intermedios en una célula animal en cultivo.
En humanos hay 70 genes diferentes que codifican para proteínas de filamentos intermedios, que al polimerizar forman los filamentos intermedios que se observan en las células. Pero además se pueden maduración alternativa del ARNm (alternative splicing) resultando en más formas proteicas diferentes. Estos monómeros o subunidades están formados por una cabeza globular en el extremo amino, una cola globular en el extremo carboxilo y un dominio central alargado o región central con unos 310 a 350 aminoácidos. Las cabezas o zonas globulares son las regiones de la proteína encargadas de interaccionar con otros componentes celulares. En los distintos tipos de filamentos intermedios estas cabezas son variables en forma y secuencia de aminoácidos. La organización molecular es importante para que estas proteínas se asocien entre sí de manera espontánea. La región central se organiza en una hélice alfa que permite a un monómero unirse a otro para formar dímeros. Dos de estos dímeros pueden asociarse entre sí de forma antiparalela mediante enlaces eléctricos para formar tetrámeros. Los tetrámeros se asocian lateralmente para formar una estructura laminada de 8 tetrámeros, que se enrrolla sobre sí misma, y se une en línea con otras para formar el filamento intermedio de unos 8 a 10 nm. La estructura formada por la longitud de 4 tetrámeros forma la unidad fundamental de ensamblaje de unos 60 nm de longitud. Las unidades fundamentales se asocian por sus extremos para formar los filamentos intermedios a modo de cuerda. Las zonas centrales de los monómeros son muy parecidas entre los distintos tipos de filamentos intermedios, en tamaño y secuencia de animoácidos, por lo que todos tienen un diámetro y forma parecidos.
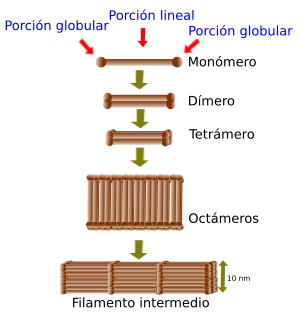
Esquema del ensamblaje de los filamentos intermedios a partir de monómeros.
Los filamentos intermedios son flexibles y resistentes, dos propiedades óptimas para soportar las tensiones mecánicas. Se ha estimado que pueden estirarse entre un 250 y un 350 % de su longitud inicial cuando se someten a fuerzas de tensión. Cuando esto ocurre disminuyen su diámetro, por lo que se estima que los monómeros pueden deslizarse unos sobre otros. Esto contrasta con los microtúbulos y los filamentos de actina, los cuales son relativamente rígidos. Además de en esta función de resistencia parece que intervienen en otros procesos celulares. Se les postula como lugar de anclaje de numerosas moléculas de señalización. Además, interaccionan directamente con orgánulos como las mitocondrias, el aparato de Golgi y los lisosomas, por lo que pueden afectar a su funcionamiento y al propio tráfico vesicular. Por ejemplo, se ha encontrado que la vimentina, un tipo de filamento intermedio, interacciona con las proteínas Rab, las cuales son necesarias para el reparto de las vesículas del tráfico vesicular.
Aunque los filamentos intermedios son más estables en el tiempo que los microtúbulos o los filamentos de actina, también pueden desorganizarse y volver a polimerizar bajo ciertas condiciones celulares como durante el desplazamiento celular, división celular o cuando se responde a cambios en la dirección de las fuerzas tensoras que soportan las células.
Los filamentos intermedios se clasifican en 6 grupos o clases. I y II son las queratinas ácidas y básicas respectivamente. Ambos tipos se combinan entre sí para dar las queratinas de las células, es decir, las queratinas son heteropolímeros. Las queratinas son abundantes en las célula epiteliales. III es una clase heterogénea donde destacan la vimentina, desmina, proteína glial fibrilar ácida y la periferina. IV es un grupo que incluye a los neurofilmentos, típicos de neuronas, a la semina, sincoilina y a la alfa-internexina. V es una clase que incluye a las láminas nucleares que forman la lámina nuclear, son los únicos filamentos intermedios que no se encuentran en el citoplasma. VI es una nueva clase añadida recientemente que incluye a proteinas de las lentes del ojo como filensina y la faquinina.
La familia de filamentos intermedios con más diversidad en sus monómeros es la de las queratinas. Así, se han encontrado monómeros diferentes en epitelios diferentes, también aparecen queratinas especiales en el pelo, las plumas y las uñas. En cada caso los filamentos de queratina son el resultado de una mezclas de distintos tipos de monómeros de queratinas. Otros filamentos intermedios también forman heteropolímeros, es decir, asociaciones entre filamentos intermedios correspondientes a clases diferentes.
Los filamentos de queratina en las células epiteliales☆ suelen estar anclados a los desmosomas y a los hemidesmosomas. La importancia de esto queda patente en una enfermedad llamada epidermolisis bullosa simple, en la cual existen mutaciones que modifican la formación de los filamentos de queratina. El resultado es una piel muy vulnerable al daño mecánico, es decir, hace falta muy poca presión para separar las células y producir descamación. Ésta es sólo una de las más de 75 enfermedades humanas asociadas a defectos en los filamentos intermedios entre las que se encuentran miopatías, esclerosis lateral amiotrófica, Parkinson, cataratas, etcétera.
| ||
domingo, 12 de febrero de 2017
Queratina.
Introducción.
Entendemos por queratina un grupo de proteínas fibrilares citoesqueléticas, de la familia de los
filamentos intermedios. Se trata de una proteína con capacidad de endurecer el tejido en el que se
acumula. A los tejidos cargados de queratina se les denomina queratinizados o cornificados.
La queratina en grandes cantidades puede tornar un tejido extremadamente duro: solo debemos
pensar en las garras de los grandes felinos o en los cuernos de un rinoceronte para darnos cuenta de
su fortaleza.
Encontramos queratinas en varios tejidos, pero el lugar más
característico es, sin duda, la piel y sus anexos. En el ser humano,
encontramos cantidades significativas de queratina en la epidermis,
sobre todo en estratos superiores, y en los anexos cutáneos
cornificados: las uñas y los pelos.
En este apartado analizaremos las queratinas más habituales en las
células de la piel y anexos cutáneos humanos, repasando los aspectos
más destacados de su biosíntesis
La familia de las queratinas.
Cuando hablamos de queratina solemos referirnos a un conjunto de proteínas de gran tamaño,
constituidas por la unión de filamentos de tamaño mucho menor.
Las subunidades básicas de la queratina se dividen en dos
grandes grupos: queratinas ácidas y queratinas básicas (y
neutras). Estas subunidades básicas están constituidas por una
sola proteína, mayormente de morfología espiral (abundantes
hélices alfa). Y poseen cantidades especialmente abundantes
de un aminoácido concreto: la cisteína (aunque la cantidad
final es variable en función del tipo de queratina).
Hay veinte precursores de la queratina, denominados del uno
al veinte (como K1, K2... hasta K20). De ellos, los ocho
primeros (K1 a K8) son queratinas básicas o neutras. El resto (de K9 a K20) son queratinas ácidas.
De entre las básicas y neutras, la K1 y K2 son típicas de la piel. De entre las básicas, las más
características de la piel son K9 y K10.
La unión de estos veinte precursores nos dará lugar a los distintos tipos
de queratina. Se han descrito al menos treinta tipos de queratina
diferentes en distintos tejidos animales.
En el ser humano, todos estos tipos de queratina se pueden agrupar en
dos conjuntos: las queratinas blandas, que constituyen la epidermis y el
vello fino (casi invisible) y las queratinas duras que forman parte de los
pelos gruesos y de las uñas. Las primeras son más ricas en componentes
hidrosolubles y más pobres en azufre, mientras que las segundas son más
pobres en componentes hidrosolubles y más ricas en azufre.
Fabricación de queratina.
Los monómeros de queratina se unen entre si para formar dímeros. El dímero es el primer
precursor de la gran molécula de la queratina en el que entran en juego varias proteínas (dos, como
su nombre indica). Y la unión no tiene lugar de cualquier manera, sino de una forma muy concreta:
una subunidad ácida se unirá con una subunidad básica. De esta forma, la macromolécula acabará
teniendo la misma proporción de subunidades básicas que de subunidades ácidas.
Posteriormente dos dímeros se unirán entre si para formar tetrámeros. Multitud tetrámeros se unen
entre si, unos detrás de otros, dando lugar a los protofilamentos. Al microscipio electrónico, los
protofilamentos constituyen un elemento fibrilar homogéneo.
Varios protofilamentos se unen entre si, en grupos de unos cuatro protofilamentos, formando una
protofibrilla.
A partir de estas protofibrillas bien cohesionadas se formarán las grandes moléculas de queratina
uniéndose muchas subunidades y torsionándose formando un trenzado. Para ello, se requiere de la presencia de una molécula que hará de puente entre los precursores de la queratina. Hablamos de la
filagrina. La filagrina.
La filagrina aparece de forma conjunta a la queratina en los gránulos de queratohialina que abundan
en el citoplasma de las células epiteliales de la epidermis a partrir de las capas superiores del estrato
espinoso.
Como indicamos, su función es formar puentes de unión entre las moléculas de queratina, es decir,
constituyen una suerte de cemento molecular que mantiene las moléculas unidas y asegura que su
unión, fusión y plegamiento son los correctos.
La filagrina se fabrica a partir de un precursor: la profilagrina. La profilagrina es una proteína de
gran tamaño. Sufrirá una serie de cortes específicos, obteniéndose la filagrina, que es una molécula
de tamaño relativamente pequeño. Una sola molécula de profilagrina, de hecho, contiene entre diez
y doce subunidades de filagrina repetidas, que se separarán por el proceso de corte.
Es decir, la filagrina se forma a partir de un precursos de gran tamaño, llamado profilagrina, que
sufre una serie de cortes específicos (modificaciones postraduccionales).
En los estratos superiores de la epidermis buena parte de la filagrina degenera, se hidroliza y pasa a
formar parte de las sustancias orgánicas que se van depositando sobre la piel y que constituyen,
entre otras cosas, el factor natural de hidratación.
Queratina y azufre.
Desde hace tiempo se conoce la importancia para las queratinas de su contenido en azufre. Ya
hemos indicado que se relaciona con su dureza. Analicemos las causas.
El azufre deriva de un componente habitual en las queratinas: un aminoácido denominado cisteína y
que posee azufre en su molécula. Las cisteínas de distintas cadenas de queratina pueden unirse entre
si, así como con las queratinas de otras proteínas, como las filagrinas, mediante puentes disulfuro
(formando un puente de unión y hablandose de cistina al referirnos a dos aminoácidos de cistina de
distintas cadenas unidas por un puente disulfuro).
Por esto, cuanto más rica en azufre sea una queratina, mayor cantidad de puentes disulfuro podrá
establecer con moléculas vecinas, endureciendo o haciendo más correosa la estructura.
Esta es la razón, así mismo, de que compuestos encargados de reblandecer la queratina, como
algunos exfoliantes o los depilatorios químicos, basan su actuación en la degradación y eliminación
de puentes disulfuro. Al eliminar estos puentes, las moléculas de queratina se separan entre si,
pierden cohesión y la proteína ve reducida considerablemente su dureza. Además, los puentes
peptídicos que unen los aminoácidos entre si quedan más expuestos, pudiendo ser degradados
mediante otros compuestos químicos o sencillamente elevando el pH a niveles que los
desestabilicen.
Los depilatorios químicos usan, por ejemplo, ácido tioglicólico a pH 11 aproximadamente y en
menos de cinco minutos son capaces de degradar la queratina hasta tal punto, que los pelos pueden
ser eliminados con una paleta de plástico.
Introducción.
Entendemos por queratina un grupo de proteínas fibrilares citoesqueléticas, de la familia de los
filamentos intermedios. Se trata de una proteína con capacidad de endurecer el tejido en el que se
acumula. A los tejidos cargados de queratina se les denomina queratinizados o cornificados.
La queratina en grandes cantidades puede tornar un tejido extremadamente duro: solo debemos
pensar en las garras de los grandes felinos o en los cuernos de un rinoceronte para darnos cuenta de
su fortaleza.
Encontramos queratinas en varios tejidos, pero el lugar más
característico es, sin duda, la piel y sus anexos. En el ser humano,
encontramos cantidades significativas de queratina en la epidermis,
sobre todo en estratos superiores, y en los anexos cutáneos
cornificados: las uñas y los pelos.
En este apartado analizaremos las queratinas más habituales en las
células de la piel y anexos cutáneos humanos, repasando los aspectos
más destacados de su biosíntesis
La familia de las queratinas.
Cuando hablamos de queratina solemos referirnos a un conjunto de proteínas de gran tamaño,
constituidas por la unión de filamentos de tamaño mucho menor.
Las subunidades básicas de la queratina se dividen en dos
grandes grupos: queratinas ácidas y queratinas básicas (y
neutras). Estas subunidades básicas están constituidas por una
sola proteína, mayormente de morfología espiral (abundantes
hélices alfa). Y poseen cantidades especialmente abundantes
de un aminoácido concreto: la cisteína (aunque la cantidad
final es variable en función del tipo de queratina).
Hay veinte precursores de la queratina, denominados del uno
al veinte (como K1, K2... hasta K20). De ellos, los ocho
primeros (K1 a K8) son queratinas básicas o neutras. El resto (de K9 a K20) son queratinas ácidas.
De entre las básicas y neutras, la K1 y K2 son típicas de la piel. De entre las básicas, las más
características de la piel son K9 y K10.
La unión de estos veinte precursores nos dará lugar a los distintos tipos
de queratina. Se han descrito al menos treinta tipos de queratina
diferentes en distintos tejidos animales.
En el ser humano, todos estos tipos de queratina se pueden agrupar en
dos conjuntos: las queratinas blandas, que constituyen la epidermis y el
vello fino (casi invisible) y las queratinas duras que forman parte de los
pelos gruesos y de las uñas. Las primeras son más ricas en componentes
hidrosolubles y más pobres en azufre, mientras que las segundas son más
pobres en componentes hidrosolubles y más ricas en azufre.
Fabricación de queratina.
Los monómeros de queratina se unen entre si para formar dímeros. El dímero es el primer
precursor de la gran molécula de la queratina en el que entran en juego varias proteínas (dos, como
su nombre indica). Y la unión no tiene lugar de cualquier manera, sino de una forma muy concreta:
una subunidad ácida se unirá con una subunidad básica. De esta forma, la macromolécula acabará
teniendo la misma proporción de subunidades básicas que de subunidades ácidas.
Posteriormente dos dímeros se unirán entre si para formar tetrámeros. Multitud tetrámeros se unen
entre si, unos detrás de otros, dando lugar a los protofilamentos. Al microscipio electrónico, los
protofilamentos constituyen un elemento fibrilar homogéneo.
Varios protofilamentos se unen entre si, en grupos de unos cuatro protofilamentos, formando una
protofibrilla.
A partir de estas protofibrillas bien cohesionadas se formarán las grandes moléculas de queratina
uniéndose muchas subunidades y torsionándose formando un trenzado. Para ello, se requiere de la presencia de una molécula que hará de puente entre los precursores de la queratina. Hablamos de la
filagrina. La filagrina.
La filagrina aparece de forma conjunta a la queratina en los gránulos de queratohialina que abundan
en el citoplasma de las células epiteliales de la epidermis a partrir de las capas superiores del estrato
espinoso.
Como indicamos, su función es formar puentes de unión entre las moléculas de queratina, es decir,
constituyen una suerte de cemento molecular que mantiene las moléculas unidas y asegura que su
unión, fusión y plegamiento son los correctos.
La filagrina se fabrica a partir de un precursor: la profilagrina. La profilagrina es una proteína de
gran tamaño. Sufrirá una serie de cortes específicos, obteniéndose la filagrina, que es una molécula
de tamaño relativamente pequeño. Una sola molécula de profilagrina, de hecho, contiene entre diez
y doce subunidades de filagrina repetidas, que se separarán por el proceso de corte.
Es decir, la filagrina se forma a partir de un precursos de gran tamaño, llamado profilagrina, que
sufre una serie de cortes específicos (modificaciones postraduccionales).
En los estratos superiores de la epidermis buena parte de la filagrina degenera, se hidroliza y pasa a
formar parte de las sustancias orgánicas que se van depositando sobre la piel y que constituyen,
entre otras cosas, el factor natural de hidratación.
Queratina y azufre.
Desde hace tiempo se conoce la importancia para las queratinas de su contenido en azufre. Ya
hemos indicado que se relaciona con su dureza. Analicemos las causas.
El azufre deriva de un componente habitual en las queratinas: un aminoácido denominado cisteína y
que posee azufre en su molécula. Las cisteínas de distintas cadenas de queratina pueden unirse entre
si, así como con las queratinas de otras proteínas, como las filagrinas, mediante puentes disulfuro
(formando un puente de unión y hablandose de cistina al referirnos a dos aminoácidos de cistina de
distintas cadenas unidas por un puente disulfuro).
Por esto, cuanto más rica en azufre sea una queratina, mayor cantidad de puentes disulfuro podrá
establecer con moléculas vecinas, endureciendo o haciendo más correosa la estructura.
Esta es la razón, así mismo, de que compuestos encargados de reblandecer la queratina, como
algunos exfoliantes o los depilatorios químicos, basan su actuación en la degradación y eliminación
de puentes disulfuro. Al eliminar estos puentes, las moléculas de queratina se separan entre si,
pierden cohesión y la proteína ve reducida considerablemente su dureza. Además, los puentes
peptídicos que unen los aminoácidos entre si quedan más expuestos, pudiendo ser degradados
mediante otros compuestos químicos o sencillamente elevando el pH a niveles que los
desestabilicen.
Los depilatorios químicos usan, por ejemplo, ácido tioglicólico a pH 11 aproximadamente y en
menos de cinco minutos son capaces de degradar la queratina hasta tal punto, que los pelos pueden
ser eliminados con una paleta de plástico.
viernes, 10 de febrero de 2017
MARTES, 8 DE ABRIL DE 2014
TÉCNICA H DE FROST
La técnica en "H" de Frost es la que más se emplea, se puede utilizar en todas las falanges, pero lo más común en el 1er dedo.
Pasos a seguir:
1.- Se realiza el primer pinchazo en la parte interna del hallux (canal peroneal), y cuando nos encontramos a nivel plantar depositamos la cantidad apropiada de anestesico
2.- Cuando ya hemos depositado en el anestésico y estamos retirando la aguja, antes de retirarla por completo dirigimos la aguja transversalmente por debajo del tendón de extensor del 1er dedo (para ello realizaremos una dorsiflexión del hallux), y depositamos mas anestésico, por último retiramos la aguja y esperamos a que el anestésico empiece a hacer efecto
3.- Por último realizamos un ultimo pinchazo en la parte lateral del hallux (canal tibial), e inyectamos los últimos mililitros de anestésico para insensibilizar esta zona. Este último pinchazo no duele porque al realizar el abordaje transversal por debajo del extensor del 1er dedo ya hemos depositado ahí anestésico.
Pasos a seguir:
1.- Se realiza el primer pinchazo en la parte interna del hallux (canal peroneal), y cuando nos encontramos a nivel plantar depositamos la cantidad apropiada de anestesico
2.- Cuando ya hemos depositado en el anestésico y estamos retirando la aguja, antes de retirarla por completo dirigimos la aguja transversalmente por debajo del tendón de extensor del 1er dedo (para ello realizaremos una dorsiflexión del hallux), y depositamos mas anestésico, por último retiramos la aguja y esperamos a que el anestésico empiece a hacer efecto
3.- Por último realizamos un ultimo pinchazo en la parte lateral del hallux (canal tibial), e inyectamos los últimos mililitros de anestésico para insensibilizar esta zona. Este último pinchazo no duele porque al realizar el abordaje transversal por debajo del extensor del 1er dedo ya hemos depositado ahí anestésico.
La anestesia local es sencilla pero desde luego encierra riesgos.
Veal el siguiente vídeo
Suscribirse a:
Entradas (Atom)
